中國經(jīng)濟網(wǎng)8月6日訊(記者朱國旺 郭文培) 繼在納斯達克交易所��、香港聯(lián)交所上市后����,今年年初����,百濟神州宣告,將赴科創(chuàng)板IPO��,成為“A+H+N”三地上市生物藥企���。7月28日���,百濟神州披露科創(chuàng)板IPO招股書(注冊稿)(下稱“注冊稿”)。此次科創(chuàng)板IPO�����,百濟神州擬發(fā)行不超過13231萬股股份��,募集資金將用于藥物臨床試驗研發(fā)�、研發(fā)中心建設、生產(chǎn)基地研發(fā)及產(chǎn)業(yè)化等項目���。
10年投入85億打造“三桿槍”
與年初申報稿不同的是��,注冊稿提到時百濟神州自主研發(fā)的創(chuàng)新藥從原來的2款增至3款���。有分析指出��,這無疑對沖擊科創(chuàng)板錦上添花��,公司韌性更被資本看好���。
2010年,百濟神州成立���。2019年11月����,百濟神州自主研發(fā)的第一款創(chuàng)新藥BTK抑制劑百悅澤(澤布替尼膠囊)上市�����,該藥當年實現(xiàn)銷售收入717萬元����,公司自此走上了創(chuàng)新兌現(xiàn)之路。次月,其第二款創(chuàng)新藥抗PD-1單抗百澤安(替雷利珠單抗注射液)相繼上市�。今年5月,其第三款創(chuàng)新藥PARP抑制劑百匯澤(帕米帕利膠囊)也上市�����。目前��,公司3款核心產(chǎn)品在熱門靶點均有布局�,總研發(fā)投入近85億元�����。
然而�,創(chuàng)新藥成功商業(yè)化本就不易,加之又躋身熱門領域���,百濟神州目前尚未實現(xiàn)盈利����。
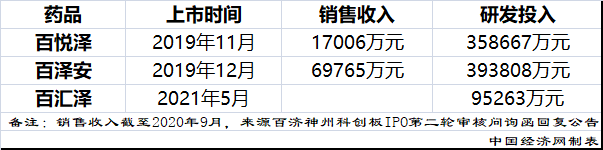
在注冊稿中�,百濟神州自稱是一家尚未盈利的生物科技公司,專注于研究�、開發(fā)、生產(chǎn)以及商業(yè)化創(chuàng)新型藥物。由于創(chuàng)新藥高投入���、長周期等屬性��,百濟神州自成立以來一直虧損���。截至去年年末,該公司累計未分配利潤達-275.83億元���。
百悅澤:適應癥少 300億元BTK抑制劑市場挑戰(zhàn)大
百悅澤是百濟神州自主研發(fā)的一款小分子藥物��,其活性成分澤布替尼是一種第二代選擇性BTK小分子抑制劑����。該藥于2019年11月獲得美國FDA加速批準上市�����,用于治療既往接受過至少一項療法的成年MCL(套細胞淋巴瘤)患者�,于2020年6月獲得我國國家藥監(jiān)局附條件批準上市,用于治療既往至少接受過一種治療的成年MCL患者及既往至少接受過一種治療的成年CLL/SLL(慢性淋巴細胞白血病/小淋巴細胞淋巴瘤)患者���。今年上半年�����,其還相繼獲得以色列��、阿聯(lián)酋��、加拿大��、中國4地藥監(jiān)部門的上市批準��,適應癥包括MCL和WM(華氏巨球蛋白血癥)���。
BTK抑制劑已有兩代藥品,第一代為伊布替尼��,于2013年11月獲FDA 批準上市���。全球范圍來看�����,2020年BTK抑制劑市場規(guī)模為72億美元����,預計2025年將達到200億美元, 2020-2025年復合增長率22.7%�。全球非霍奇金淋巴瘤(NHL)患病人數(shù)2019年達到250萬人。
美國范圍內(nèi)��,2020年BTK抑制劑市場規(guī)模為48億美元��,預計2025年將達到121億美元�,2020-2025年復合增長率20.3%,美國NHL患病人數(shù)2019年達到45萬人���。中國范圍內(nèi)����,2020年BTK抑制劑市場規(guī)模為13億元�����,預計2025年將達到131億元�����,2020-2025年復合增長率58.6%���,中國NHL患病人數(shù)2019年達到49萬人��。
百悅澤是第3款在美國上市�����、第2款在中國上市的BTK抑制劑�。全球范圍內(nèi)目前共有4款BTK抑制劑已獲批,其中強生/艾伯維的億珂�����、阿斯利康的CALQUENCE�����、百濟神州的百悅澤已獲得美國FDA 批準�。在中國市場方面����,共有3款BTK抑制劑獲批,分別是強生的億珂��、百濟神州的百悅澤�����、諾誠健華的宜諾凱。
此外����,相關臨床研究也炙手可熱。目前全球范圍內(nèi)共有10種用于治療腫瘤相關適應癥的BTK抑制劑處于臨床試驗階段�,中國市場有8種用于治療腫瘤相關適應癥的BTK抑制劑處于臨床試驗階段。
可見��,無論是市場空間還是獲批適應癥���,百濟神州都面臨挑戰(zhàn)�����。一方面����,百悅澤在中國市場獲批晚于億珂,在美國市場獲批晚于億珂和CALQUENCE�,喪失了部分產(chǎn)品先發(fā)優(yōu)勢�����;另一方面,百悅澤在中國附條件獲批3項適應癥�,在美國加速獲批1項適應癥,數(shù)量上少于億珂(中國3項適應癥���、美國5項適應癥),在市場推廣方面面臨挑戰(zhàn)�。
百澤安:醫(yī)保談判面臨“價格戰(zhàn)” 千億元PD-1賽道擁擠
百澤安是百濟神州第二款自主研發(fā)藥品,是抗PD-1單抗藥物����,獲批適應癥包括cHL(經(jīng)典型霍奇金淋巴瘤)����、尿路上皮癌(UC)、非小細胞肺癌(NSCLC)��、肝細胞癌(HCC)。
PD-1向來是擁擠賽道�。記者了解到,中國市場目前已有7種抗 PD-1單抗藥物和2種抗PD-L1單抗藥物獲批��。百澤安是第6款在中國上市的抗PD-1單抗���,也是第4款國產(chǎn)PD-1產(chǎn)品��。
除百澤安外����,本土已獲批的抗PD-1單抗藥物有君實生物的拓益、信達生物/禮來的達伯舒及恒瑞醫(yī)藥的艾瑞卡�����,分別于2018年12月�����、2018年12月和2019 年5月獲批。8月5日�����,康方生物和正大天晴聯(lián)合開發(fā)的派安普利單抗獲批上市,是國產(chǎn)第五款PD-1產(chǎn)品��。
值得一提的是,前4款PD-1單抗藥物均被納入醫(yī)保范圍�,百澤安不得不面臨價格“廝殺”。據(jù)了解�,2020年納入醫(yī)保范圍后�����,拓益的最新中位價格為906元/80毫克和2101元/240毫克;達伯舒于2019年通過談判納入醫(yī)保范圍���,2021年最新中位價格為2843元/100毫克��;2020年納入醫(yī)保范圍后���,艾瑞卡的最新中位價格為2928元/0.2克����。2020年����,拓益�����、達伯舒和艾瑞卡在中國市場的銷售額分別達到10.9億元、24.9億元����、48.9億元���。
2020年12月28日�,百澤安針對cHL和UC的兩項附條件獲批適應癥被納入國家醫(yī)保目錄��,于2021年3月1日生效��,2021年最新中位價格低至2180元/100毫克。
從市場來看,全球范圍內(nèi)���,2020年抗PD-1/PD-L1單抗市場規(guī)模為286億美元��,預計2025年將達到626億美元,2020-2025年復合增長率17.0%��。針對抗 PD-1/PD-L1的主要適應癥規(guī)模,全球非小細胞肺癌新發(fā)病例數(shù)2019年達到183.0萬人,預計2024年將達到210.1萬人�;肝細胞癌新發(fā)病例數(shù)2019 年達到77.6萬人���,預計2024年將達到87.7萬人�����;尿路上皮癌新發(fā)病例數(shù)2019年達到50.8萬人���,預計2024年將達到58.7萬人。
同樣�,全球范圍內(nèi)抗PD-1/PD-L1候選藥物臨床試驗競爭更為激烈,截至2020年12月31日���,ClinicalTrials.gov共登記4121條臨床試驗�,其中3557個試驗正在進行中。
可以看出���,百澤安在中國市場獲批晚于其他5款抗PD-1單抗藥物�,同樣喪失部分產(chǎn)品先發(fā)優(yōu)勢。同時��,醫(yī)保談判使得百濟神州不得不打“價格戰(zhàn)”��,利潤無疑將受影響�����。
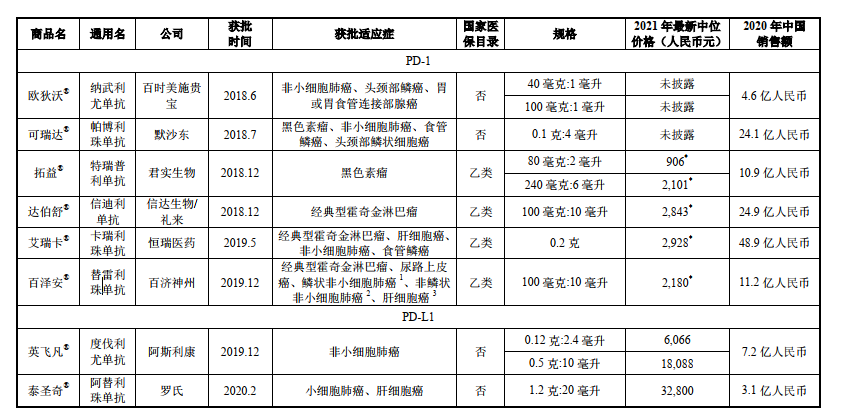
PD-1/PD-L1市場情況(來源:百濟神州注冊稿)
百匯澤:適應癥重合 百億元PARP抑制劑市場難進軍
今年5月�����,百濟神州第三款自主研發(fā)的一款小分子藥物百匯澤在中國附條件獲批上市。該藥活性成分帕米帕利是一種高選擇性聚腺苷二磷酸核糖聚合酶1(PARP1)和PARP2小分子抑制劑�����,用于治療既往接受過至少兩線化療���、伴有胚系 BRCA 突變的復發(fā)性晚期卵巢癌(OC)��、輸卵管癌(FTC)或原發(fā)性腹膜癌(PPC)患者�。
聚腺苷二磷酸核糖聚合酶(PARP)是一類催化ADP核糖基化的細胞核酶��,在以DNA單鏈損傷修復為主的DNA損傷修復中發(fā)揮著關鍵性作用�����。目前,中國和美國各有4款PARP抑制劑藥物。百匯澤是第4款在中國上市的PARP抑制劑�,不過,其獲批適應癥與其他三款已獲批 PARP 抑制劑所覆蓋的適應癥存在部分重合�����。
據(jù)了解,其他3款分別是阿斯利康的利普卓、再鼎醫(yī)藥的則樂����、恒瑞醫(yī)藥的艾瑞頤���,分別于2018年8月���、2019年12月和2020年12月獲批�。在醫(yī)保方面���,利普卓于2019年通過談判納入醫(yī)保范圍�����,則樂于2020年納入醫(yī)保范圍,艾瑞頤目前尚未納入醫(yī)保范圍��。2020年����,利普卓和則樂在中國市場的銷售額分別達到10.5億元��、2.1億元��。
全球范圍內(nèi),2020年PARP抑制劑市場規(guī)模為24億美元�����,預計2025年將達到123億美元�����,2020-2025年復合增長率38.3%。針對帕米帕利的主要適應癥規(guī)模���,全球OC新發(fā)病例數(shù)2019年達到30.2萬人,預計2024年將達到33.4萬人�; GC新發(fā)病例數(shù)2019年達到106.1萬人,預計2024年將達到121.2萬人����;乳腺癌新發(fā)病例數(shù)2019年達到213.4萬人,預計2024年將達到236.0萬人��。
中國范圍內(nèi)��,2020年PARP抑制劑市場規(guī)模為14億元��,預計2025年將達到147億元,2020-2025年復合增長率60.3%���。針對帕米帕利的主要適應癥規(guī)模���,中國OC新發(fā)病例數(shù)2019年達到5.4萬人���,預計2024年將達到5.8萬人���;GC新發(fā)病例數(shù)2019年達到45.6萬人��,預計2024年將達到52.6萬人�。乳腺癌新發(fā)病例數(shù)2019年達到32.6萬人���,預計2024年將達到35.2萬人����。
同上兩款產(chǎn)品一樣�,加之適應癥存在部分重合�����,因此百匯澤也喪失了先發(fā)優(yōu)勢�����,市場滲透率提升挑戰(zhàn)猶存�����。
值得注意的是�����,目前全球范圍內(nèi)共有13種用于治療腫瘤相關適應癥的PARP 抑制劑處于臨床階段���,其中處于III期臨床試驗的有3種產(chǎn)品��,中國市場有6種用于治療腫瘤相關適應癥的 PARP抑制劑處于臨床試驗階段����。
在全球市場,腫瘤免疫治療是一種相對新興的腫瘤治療手段��,并因其相對更好的療效逐漸給更多的患者群體帶來新的治療選項�����。相關產(chǎn)品包括細胞免疫治療����、細胞因子、腫瘤疫苗���、抗體及其它腫瘤免疫產(chǎn)品。根據(jù)弗若斯特沙利文分析, 2020年���,全球腫瘤免疫治療市場達到351億美元�����,并預計將以25.3%的復合年增長率于2025年擴大至1082億美元�。
未來���,百濟神州在腫瘤市場表現(xiàn)究竟如何?重金打造的“三桿槍”能否幫助百濟神州實現(xiàn)扭虧?讓我們拭目以待�����。